Альдегиды превращаются в кислоты под действием. I
Практически все химические вещества, окружающие нас, тестируются человеком, исходя из его запросов и потребностей. Каждое соединение имеет уникальный, только ему присущий набор признаков и свойств, из которых отбираются полезные и необходимые нам в повседневной жизни. Альдегиды, о которых пойдет речь, также не являются исключением.
Скромное дитя органической химии
Среди соединений углерода, которые принято называть органическими, есть хорошо известные, которые как говорится, «у всех на слуху». Например, глюкоза, этиловый спирт или пластмассы. Альдегидам в этом смысле не повезло. О них известно разве что узким специалистам, да еще учащимся старших классов, усиленно штудирующим химию для поступления в вуз. На самом же деле такие соединения (как например, уксусный альдегид) химические свойства которого мы рассмотрим, широко используется как в промышленном производстве, так и в быту.
Яблоко раздора
Увы, но открытия в науке довольно часто происходят отнюдь не безоблачно. Альдегиды, их химическое строение и свойства были открыты в результате длительных споров и дискуссий в среде ученых XIX столетия. А такие известные химики как Либих и Дёберейнер даже не на шутку повздорили, выясняя, кому же на самом деле принадлежит пальма первенства в получении и выделении в чистом виде уксусного альдегида. Его добыли из паров этилового спирта, пропущенных над платиновой сеткой, служащей катализатором реакции. Единственное, что смогло примирить оппонентов, так это безоговорочное принятие всеми химиками названия нового класса веществ - альдегиды, что дословно обозначает «безводородные алкоголи». Оно указывает на способ получения их из спиртов реакцией отщепления двух атомов водорода.

Ни с чем не перепутаешь
Рассматривая физические и химические свойства альдегидов, легко убедиться, что они достаточно специфичны. Так, формальдегид, являющийся токсичным газом, имеет резкий удушающий запах. Его 40%-ый водный раствор, называемый формалином, служит причиной особенного запаха в анатомических лабораториях и моргах, где его применяют как антигнилостное средство, консервирующее белки органов и тканей.

А уксусный альдегид, являющийся следующим в гомологическом ряду, представляет собой хорошо растворимую в воде бесцветную жидкость с неприятным запахом прелых яблок. Альдегиды, химические свойства, которых характеризуются реакциями окисления и присоединения, могут превращаться в вещества генетически близких классов: карбоновых кислот или спиртов. Рассмотрим их на конкретных примерах.
Визитная карточка альдегидов
В органической химии, как, впрочем, и в неорганической, существует такое понятие как «качественная реакция». Её можно сравнить с маяком, сигнализирующим о том, что мы имеем дело именно с веществами конкретного класса, например, с альдегидами. Подтверждают химические свойства альдегидов реакции с аммиачным раствором оксида серебра и с гидроксидом меди при нагревании (реакция серебряного зеркала)

Продуктом реакции будет чистое серебро, выделившееся в виде зеркального слоя на стенках пробирки.

В результате реакции выпадает осадок кирпичного цвета - закись меди.
Вещества-двойники
Сейчас подошло время разобраться с таким явлением, характерным для всех органических веществ, в том числе и для альдегидов, как изомерия. Она напрочь отсутствует в мире неорганической химии. Там все просто: одной химической формуле соответствует только одно конкретное соединение с присущими ему физическими и химическими свойствами. Например, формуле HNO 3 соответствует одно вещество, называемое нитратной кислотой, имеющее температуру кипения 86°С, с едким запахом, очень гигроскопичное.
В царстве же органической химии живут-поживают вещества-изомеры, у которых формулы одинаковы, а свойства различны. Например, формулу C 4 H 8 O имеют два совершенно разных альдегида: бутаналь и 2-метилпропаналь.
Формулы их:

Изомерные альдегиды, химические свойства, которых зависят от их состава и строения, служат прекрасным доказательством гениальной теории строения органических соединений, созданной российским ученым М. Бутлеровым. Его открытие имеет такое же фундаментальное значение для химии, как периодический закон Д Менделеева.

Уникальный углерод
Прекрасным доказательством, подтверждающим теорию М. Бутлерова служат химические свойства альдегидов. Органическая химия, благодаря исследованиям российского ученого, наконец смогла ответить на вопрос, изводивший своею сложностью не одно поколение ученых, а именно: как объяснить поражающее воображение многообразие органических соединений, в основе которого лежит явление изомерии. Рассмотрим строение молекул двух альдегидов-изомеров: бутаналя и 2-метилпропаналя, имеющих одну и ту же молекулярную формулу - C 4 H 8 O, но различные структурные, а значит, отличающиеся друг от друга физическими и химическими свойствами.

Обратим внимание на две важнейшие особенности атома углерода, которые введены как постулаты в теорию М. Бутлерова:
1. Углерод в органических соединениях всегда четырёхвалентен.
2. Атомы углерода способны соединяться друг с другом и образовывать различные пространственные конфигурации: неразветвленные и разветвленные цепи или циклы.
На них, согласно валентности, нанизываются атомы других химических элементов: водорода, кислорода, азота, образуя, таким образом, весь гигантский арсенал существующих органических соединений (а их более 10 млн.) К тому же количество постоянно увеличивается за счет новых веществ, получаемых в химии органического синтеза.
Чем полярнее, тем лучше
Продолжая изучать альдегиды, их химическое строение и свойства, остановимся на явлении полярности атомов, входящих в состав молекул альдегидов. Так, атом углерода альдегидной группы в молекуле уксусного альдегида приобретает частичный положительный заряд, а атом кислорода - частичный отрицательный. Причина их возникновения лежит в следующем: электронная плотность π-связи является более подвижной, чем σ-связь.

В общей формуле альдегидов, где R -углеводородный радикал, связанный с альдегидной группой, на атоме кислорода образуется частичный отрицательный заряд, а на атоме углерода - частичный положительный. Таким образом, функциональная группа альдегидов становится сильно поляризованной, что обуславливает большую реакционную способность этих веществ. Проще говоря, чем больше поляризованы атомы в молекуле вещества, тем лучше и быстрее оно вступает в химические реакции. Быстрая окислительная способность атома водорода в альдегидной группе и реакционная активность карбонильной группы обеспечивает альдегидам характерные им реакции присоединения и полимеризации.
Жизнь в пластмассовом мире
Именно альдегиды, химические свойства которых обусловлены способностью к реакциям поликонденсации и полимеризации, стали родоначальниками фенопластов и аминопластов - базовых материалов современной индустрии полимеров. Сырьем для ее предприятий служат формальдегид и уксусный альдегид. Так, из фенолформальдегидных смол получают фенопласты - важнейшие заменители черных и цветных металлов. Формальдегид получают окислением метана при нагревании его до 600°С в смеси с воздухом, а также окислением нагретого до 300°С метанола над медным катализатором. Таким образом, альдегиды, получение и химические свойства, которых мы рассматриваем, являются важным сырьем в реакциях органического синтеза.

Делаем выводы
Как видим, в послужном списке альдегидов достаточно необходимых и важных веществ, таких как, например, формальдегид и уксусные альдегиды, химические свойства которых человек с успехом использует в различных сферах своей жизнедеятельности.
Альдегидами называются органические соединения, в которых карбонильная группа (С-О) связана с водородом и радикалом R (остатки алифатических, ароматических и гетероциклических соединений):
Полярность карбонильной группы обеспечивает полярность молекулы в целом, поэтому альдегиды имеют более высокие температуры кипения, чем неполярные соединения сравнимой молекулярной массы.
Поскольку атомы водорода в альдегидах связаны только с атомом углерода (близкие относительные электроотрицательности), межмолекулярные водородные связи не образуются. Поэтому температуры кипения альдегидов ниже, чем у соответствующих спиртов или карбоновых кислот. В качестве примера можно сравнить температуры кипения метанола (Т^ 65 °С), муравьиной кислоты (Гкип 101 °С) и формальдегида (7^, -21 °С).
Низшие альдегиды растворимы в воде, вероятно, вследствие образования водородных связей между молекулами растворенного вещества и растворителя. Высшие альдегиды хорошо растворяются в большинстве обычных органических растворителей (спирты, эфиры). Низшие альдегиды имеют резкий запах, у альдегидов с С3-С6 весьма неприятный запах, в то время как высшие альдегиды обладают цветочными запахами и применяются в парфюмерии.
В химическом отношении альдегиды - весьма реакционноспособные соединения. Наиболее характерны для альдегидов реакции нуклеофильного присоединения, что обусловлено присутствием в молекуле электрофильного центра - карбонильного атома углерода группы С=0.
Многие из этих реакций, например, образование оксимов, семикарбазонов и других соединений, используются в качественном и количественном анализе ЛС из группы альдегидов потому, что продукты присоединения альдегидов характеризуются определенной для каждого альдегида температурой плавления. Так, альдегиды при встряхивании с насыщенным раствором гидросульфита натрия легко вступают в реакцию присоединения:
Продукты присоединения представляют собой соли, имеющие определенную температуру плавления, хорошо растворимы в воде, но не растворимы в органических растворителях.
При нагревании с разбавленными кислотами гидросульфитные производные гидролизуются до исходных соединений.
Способностью альдегидов образовывать гидросульфитные производные пользуются как для определения подлинности препарата с альдегидной группой в молекуле, так и для очистки альдегидов и выделения их из смесей с другими веществами, не реагирующими с гидросульфитом натрия.
 |
|||||||||
Альдегиды также легко присоединяют аммиак и другие азотсодержащие нуклеофилы. Продукты присоединения обычно малоустойчивы и легко подвергаются дегидратации и полимеризации. Образующиеся в результате полимеризации циклические соединения при нагревании с разбавленными кислотами легко разлагаются, вновь освобождая альдегид:
| r-ch-nh2 | г з | -NH R-СС |
| -зн2о " | ||
| он |
Альдегиды легко окисляются. Оксид серебра(І) и другие окислители с невысоким значением окислительного потенциала способны окислять альдегиды. Например, для альдегидов характерна реакция образования серебряного зеркала, которая протекает с аммиачным раствором AgN03:
AgN03 + 3NH3 - OH + NH4N03
Реактив Толленса
При этом на стенках пробирки образуется зеркальный налет металлического серебра:
2OH + RCOH 2Agi + RCOOH + 4NH3T + Н20
Аналогично альдегиды могут восстанавливать медь(П) до меди(1). Для проведения реакции к раствору альдегида добавляют реактив Фелинга (щелочной раствор тартратного комплекса меди(П)) и нагревают. Сначала образуется желтый осадок гидроксида меди(1) - СиОН, а затем красный - оксида меди(1) - Си20:
2KNa + RCOH + 3NaOH + 2КОН -
2CuOHi + RCOONa + 4KNaC4H406 + 2H20 2CuOH - Cu20 + H20
К окислительно-восстановительным относится также реакция взаимодействия альдегидов с реактивом Несслера в щелочной среде; при этом выпадает темный осадок восстановленной ртути:
K2 + RCOH + ЗКОН - RCOOK + 4KI + Hgl + 2Н20
Следует иметь в виду, что реакция с реактивом Несслера более чувствительна, поэтому ее используют для обнаружения примесей альдегидов в ЛС. Подлинность лекарственных средств, содержащих альдегидную группу, подтверждают менее чувствительными реакциями: серебряного зеркала или с реактивом Фелинга. Некоторые другие соединения, например полифенолы, также окисляются соединениями Ag(I) и Си(П), т.е. реакция не является специфической.
Формальдегид и уксусный альдегид склонны к полимеризации. Формальдегид полимеризуется, образуя циклические тримеры, тетрамеры или линейные полимеры. Реакция полимеризации протекает в результате нуклеофильной атаки кислорода одной молекулы карбонильного атома углерода другой:
Так, из 40 % водного раствора формальдегида (формалина) образуется линейный полимер - параформ (и = 8 - 12), тример и тетрамер.
Для альдегидов характерны наркотические и дезинфицирующие свойства. По сравнению со спиртами альдегидная группа усиливает токсичность вещества. Введение галогена в молекулу альдегида повышает его наркотические свойства. Например, наркотические свойства хлораля более выражены, чем у уксусного альдегида:
![]() с!3с-сС
с!3с-сС
Получение. Альдегиды могут быть получены окислением первичных спиртов хромовой кислотой (Na2Cr04, H2S04) при кипячении или перманганатом калия в щелочной среде:
Дегидрирование первичных спиртов осуществляют над медным катализатором (Си, Сг203) при 300-400 °С.
Промышленное производство метаналя основано на парофазном окислении метанола с железомолибденовым катализатором:
2СН3ОН + 02 500 ~600 2СН2=0 + Н20
Раствор формальдегида (формалин)
Получение. Формалин - это водный раствор формальдегида (40 %), стабилизированный метанолом (6-10 %). Европейская Фармакопея содержит ФС «Формальдегида раствор (35 %)» (см. табл. 9.1). В лабораторных условиях формальдегид может быть получен дегидрированием метанола над медью или деполимеризацией параформа.
Определение подлинности. Фармакопейный способ - реакция серебряного зеркала.
Поскольку формальдегид легко вступает в реакции конденсации, например, с гидроксилсодержащими ароматическими соединениями с образованием окрашенных соединений, ГФ рекомендует также использовать для его идентификации реакцию с салициловой кислотой, в результате которой появляется красное окрашивание:
|
||||||||||
|
||||||||||
|
||||||||||
Аналогично протекает реакция с хромотроповой кислотой с образованием синефиолетовых и красно-фиолетовых продуктов (ЕФ).
Для определения подлинности фармальдегида могут быть использованы реакции с азотсодержащими нуклеофилами, например первичными аминами:
H-Ctf° + H2N-R - н-с^^К + Н20
Образующиеся N-замещенные имины (основания Шиффа) малорастворимы, некоторые из них окрашены, другие дают окрашенные соединения с ионами тяжелых металлов. ЕФ предлагает реакцию с фенилгидразином. В присутствии калия феррици- анида в кислой среде образуются продукты реакции интенсивно красного цвета.
Испытания на чистоту. Контроль примеси муравьиной кислоты осуществляют, определяя кислотность. Согласно ГФ, концентрация муравьиной кислоты в препарате не должна превышать 0,2 %; устанавливают содержание муравьиной кислоты методом нейтрализации (ГФ). Согласно ЕФ, метанол определяют методом газовой хроматографии (9-15 % об.). Сульфатная зола - не более 0,1 % в навеске 1,0 г.
I2 + 2NaOH - Nal + NaOI + Н20
Гипойодит окисляет формальдегид до муравьиной кислоты. Непрореагировавший гипойодит при подкислении раствора избытком серной кислоты превращается в йод, который оттитровывают тиосульфатом натрия:
НСОН + NaOI + NaOH - HCOONa + Nal + H20 NaOI + Nal + H2S04 -*■ I2 + Na2S04 + H20 I2 + 2Na2S203 - Na2S406 + 2NaI
Возможно использование и других титрующих агентов при определении формальдегида: водорода пероксида в щелочном растворе, церия(ІУ) сульфата, натрия сульфита.
Препарат можно рассматривать как пролекарство, так как физиологическое действие оказывает не сам гексаметилентетрамин, а формальдегид, выделяющийся при разложении препарата в кислой среде. Именно этим объясняется включение его в настоящий раздел (см. табл. 9.1).
Получение. Уротропин (тетраазаадамантан) получают конденсацией метаналя и аммиака из водных растворов. Промежуточный продукт реакции - гексагидро-1,3,5- триазин:
| ll Гексагидро- Уротропин 1,3,5-трназин |
Определение подлинности. При нагревании смеси препарата с разведенной серной кислотой образуется аммонийная соль, из которой при добавлении избытка щелочи выделяется аммиак:
(CH2)6N4 + 2H2S04 + 6Н20 - 6НСОН + 2(NH4)2S04 (NH4)2S04 + 2NaOH - 2NH3t + Na2S04 + 2H20
Гексаметилентетрамин можно обнаружить также по красному окрашиванию раствора при добавлении салициловой кислоты после предварительного нагревания с серной кислотой (см. определение подлинности формальдегида).
Испытания на чистоту. В препарате не допускается присутствие примесей органических соединений, параформа, солей аммония. ГФ указывает допустимые пределы содержания примесей хлоридов, сульфатов, тяжелых металлов.
Количественное определение. Для количественного определения гексаметилентетрамина ГФ предлагает использовать метод нейтрализации. Для этого навеску препарата нагревают с избытком 0,1М раствора серной кислоты. Избыток кислоты оттитровы- вают раствором щелочи концентрацией 0,1 моль/л (индикатор метиловый красный).
На способности гексаметилентетрамина давать с йодом тетрайодиды основан йодометрический метод количественного определения.
Альдегиды и кетоны характеризуются присутствием в молекуле карбонильной группы . В альдегидах карбонильная группа связана с одним атомом водорода и одним углеводородным радикалом. Все альдегйды содержат группу
называемую альдегидной группой.
Общая формула альдегидов:
Молекула альдегида содержит на два атома водорода меньше, чем молекула соответствующего спирта

т. е. альдегид - это дегидрированный (окисленный) спирт. Отсюда и произошло название «альдегид» - от соединения двух сокращенных латинских слов alcohol dehydrogenatus (дегидрированный спирт).
Предельные альдегиды и кетоны имеют одинаковую суммарную формулу
Номенклатура и изомерия. Названия альдегидов происходят от названий предельных кислот, в которые они превращаются при окислении. Это объясняется тем, что многие кислоты были открыты и получили название раньше, чем соответствующие им альдегиды.
Названия и формулы некоторых простейших альдегидов приведены ниже:

Для составления названий альдегидов по женевской номенклатуре прибавляют к названию углеводорода с таким же числом углеродных атомов окончание аль. В сложных случаях положение альдегидной группы обозначают цифрой, которая ставится после этого окончания:

Изомерия альдегидов обусловлена изомерией цепи углеродных атомов углеводородного радикала:

Названия кетонов по рациональной номенклатуре производят от названий радикалов, входящих в их молекулу, с добавлением окончания кетон, например:

Некоторые кетоны носят исторически сложившиеся названия, например диметилкетон называется ацетоном.
По женевской номенклатуре названия кетонов производят прибавляя к названию соответствующего углеводорода окончание он. В случае разветвленной цепи кетона нумерацию углеродных атомов начинают с того конца, к которому ближе находится разветвление (по правилам нумерации углеводородов). Место
занимаемое карбонильной группой, обозначается в названии дифрой, стоящей после окончания, например:

Физические свойства. Первый член гомологического ряда альдегидов - муравьиный альдегид - газ; средние представители жидкости; высшие альдегиды - твердые вещества. Низшие альдегиды обладают резким запахом, хорошр смешиваются с водой. Средние альдегиды растворимы в воде умеренно; высшие альдегиды - нерастворимы. Все альдегиды хорошо растворяются в спирте и эфире.
Низшие кетоны - жидкости с характерным запахом, легко смешивающиеся с водой. Высшие кетоны - твердые вещества. Все кетоны хорошо растворимы в спирте и эфире.
Химические реакции альдегидов и кетонов. Альдегиды и кетоны чрезвычайно реакционноспособные органические вещества. Многие их реакции протекают без нагревания и давления. Особенно характерны для альдегидов и кетонов реакции, которые протекают с участием карбонильной группы. Существуют, однако, некоторые различия в реакциях альдегидов и кетонов. Как правило, альдегиды более реакционноспособны по сравнению с кетонами.
Реакции присоединения: К карбонильной группе альдегидов и кетонов может присоединяться ряд различных веществ. При этом одна из связей, соединяющих атомы кислорода и углерода в карбонильной группе, разрывается, и к образовавшимся свободным валентностям присоединяются части реагирующего вещества. Если присоединяющееся вещество содержит водород, то последний всегда направляется к карбонильному кислороду; карбонильная группа при этом превращается в гидроксильную:

С электронной точки зрения эта" реакционная особенность карбонильного кислорода в альдегидах и кетонах объясняется тем, что электронные облака, образующие связь между атомами углерода и кислорода в карбонильной группе, сдвинуты к атому кислорода, так как последний сильнее притягивает электроны, чем атом углерода. В результате двойная связь оказывается сильно поляризованной:
К поляризованной двойной связи различные вещества присоединяются в определенйом направлении. Рассмотрим некоторые реакции присоединения, характерные для альдегидов и кетонов.
Присоединение синильной кислоты Связь в молекуле синильной кислоты также поляризована, и поэтому водород, имеющий некоторый положительный заряд, присоединяется к атому кислорода, а группа к атому углерода:

Получающиеся в этом случае срединения носят название циангиоринов (или оксинитрилов) и представляют" собой соединения со смешанными функциями (содержащие одновременно гидроксил и цианогруппу). Оксйнитрилы служат исходными веществами для синтеза различных органических соединений.
Присоединение бисульфита натрия (кислого сёрнистокислого натрия

Полученные соединения (бисульфитные соединения) - кристаллические вещества. Они используются в лабораторной практике для выделения альдегидов и кетонов в чистом состоянии из их смесей с другими веществами, так как легко разлагаются при
кипячении с содой или разбавленными кислотами с образованием исходных альдегидов и кетонов.
Присоединение металлоорганических, соединений к карбонильной группе альдегидов и кетонов рассмотрено на стр. 165.
Восстановление альдегидов и кетонов можно рассматривать как реакцию присоединения молекулы водорода к карбонильной группе. При восстановлении альдегидов образуются первичные спирты, а при восстановлении кетонов - вторичные:

Реакции замещения в ряду альдегидов и кетонов приводят к замене кислорода карбонильной группы на другие атомы или радикалы.
Действие пятигалоидного фосфора. При действии, например, пятихлористого фосфора происходит замещение карбонильного кислорода на два атома хлораи образуется дигалоидное про лзводное углеводорода:

Эти дигалоидные соединения, реагируя с водой, способны снова давать исходные альдегиды и кетоны.
Действие гидроксиламина. При действии гидроксиламина на альдегиды и кетоны образуются соответственно - альдоксимы и кетоксимы (гидроксиламин можно рассматривать как аммиак, у которого один атом водорода замещен на гидроксил):

Получающиеся в результате этой реакции оксимы в большинстве случаев представляют собой кристаллические вещества и служат для открытия и выделения альдегидов и кетонов в чистом виде.
Реакции окисления. Альдегиды легко окисляются различными окислителями, переходя в карбоновые кислоты:

Например, альдегиды легко отнимают кислород от окислов некоторых металлов. На этом свойстве основана так называемая реакция серебряного зеркала. Она заключается в том, что пр» нагревании альдегида с аммиачным раствором окиси серебра происходит окисление альдегида в кислоту и восстановление окиси серебра до металлического серебра:
Металлическое серебро оседает на стенках сосуда и образует блестящую зеркальную поверхность.
Кетоны окисляются значительно труднее. Лишь при очень энергичном окислении происходит разрыв их углеродной цепи образуются две кислоты, например:

Реакции с участием атома водорода в -положении относительно карбонильной группы.
Действие галоидов. Карбонильная группа вальдегидах и кетонах сильно влияет на подвижность водородных атомов, находящихся у углерода, стоящего рядом с карбонильной группой -положении). Так, например, при действии на альдегиды или кетоны брома или хлора они легко замещают атомы водорода в -положении:

Атомы галоида, вступившие в -положение к карбонильной группе альдегидов или кетонов, также обладают весьма большой реакционной способностью.
Реакции конденсации. Реакциями конденсации называются такие реакции уплотнения, при которых происходит образование новых углерод-углеродных связей. Реакции конденсации могут протекать без выделения простых молекул (воды, аммиака, хлористого водорода и т. п.) или же с выделением их.
Альдегиды легко вступают в реакции конденсации. Так, например, молекула уксусного альдегида под действием небольших количестб разбавленной щелочи на холоду конденсируется с другой молекулой того же альдегида:

Полученное соединение, содержащее альдегидную и спирто вую группы, получило название альдоля (сокращенное от альдегидоалкоголь), а приведенная выше реакция - альдольной конденсации. Как видно из уравнения реакции, альдольная конденсация идет за счет подвижного атома водорода в -положении к карбонильной группе.
В несколько других условиях конденсация может протекать с образованием новой двойной углерод-углеродной связи:

Полученное соединение называется кротоновым альдегидом, а реакция - кротоновой конденсацией.
Кетоньг также способны к реакциям конденсации, которые протекают несколько сложнее, чем для альдегидов.
Характерные реакции альдегидов. Для альдегидов, как соединений более реакционноспособных, чем кетоны, характерны еще следующие реакции:
Образование сложных эфиров. Если к альдегиду прибавить небольшое количество алкоголята алюминия, то протекает энергичная реакция, при которой как бы происходит окисление одной молекулы альдегида за счет восстановления другой молекулы альдегида, и образуется сложный эфир:

Эта реакция иосит название реакции Тищенко, по имени открывшего ее русского ученого.
Образование ацеталей. При нагревании альдегидов со спиртами в присутствии небольших количеств минеральных кислот происходит реакция:

Полученное соединение носит название ацеталя и представляет собой как бы простой эфир неустойчивого двухатомного спирта:

Реакция образования ацеталей обратима. При гидролизе в присутствии кислот ацетали легко распадаются с образованием исходных альдегидов и спиртов. 4
Полимеризация. Альдегиды могут образовывать линейные или циклические полимеры, причем в обоих случаях остатки молекул альдегидов связываются между собой через атом

В качестве веществ, ускоряющих процесс полимеризации альдегидов, применяются минеральные, кислоты. Циклические полимеры при нагревании расщепляются на молекулы исходных альдегидов.
Способы получения. Окисление спиртов. Как мы уже знаем, при окислении первичных спиртов образуются альдегиды, при окислении вторичных - кетоны. Окисление можно проводить с помощью различных окислителей, например бихроматом калия в кислой среде или кислородом воздуха в присутствии катализаторов - платины, меди и др. В обоих случаях реакции протекают по схеме:

Получение из дигалоидпроиззодных углеводородов. Если оба атома галоида находятся у одного и того же углеродного атома, то при нагревании таких галоидпроизводных с водой или лучше со щелочью происходит образование альдегидов или кетонов:

Действие воды на ацетиленовые углеводороды (реакция Кучерова). При действии воды на ацетилен в присутствии солей двухвалентной ртути получается уксусный альдегид:

Гомологи ацетилена в этих условиях образуют кетоны:

Оксосинтез. Оксосинтезом называется способ получения кислородсодержащих органических соединений путем взаимодействия непредельных углеводородов с окисью углерода и водородом при повышенной температуре, в присутствии кобальтового катализатора и при давлении . В результате этого процесса образуются альдегиды, содержащие на один атом углерода больше, чем исходный олефин:

Муравьиный альдегид (формальдегид) Бесцветный газ с резким специфическим запахом; хорошо растворим в воде. Водный раствор формальдегида, содержащий формальдегида в раствора, носит название формалина. При выпаривании раствора формальдегид полимеризуется с образованием твердой смеси низкомолекулярных полиоксиметиленов (параформальдегид), под действием кислот вновь дающей формальдегид.
Формальдегид - первый член гомологического ряда альдегидов. В общей формуле
у формальдегида вместо алкильного радикала находится атом водорода. Поэтому некоторые химические свойства формальдегида резко отличаются от свойств других альдегидов этого ряда. Так, найример, при действии щелочей формальдегид в отличие других альдегидов жирного ряда, осмоляющихся щёлочами, образует метиловый спирт и соль муравьиной кислоты;
При этой реакции одна молекула формальдегида восстанавливается до спирта, а другая окисляется до кислоты.
Формальдегид в громадных количествах применяется для производства фенолоформальдегидных, карбамидных и других синтетических полимеров. Исключительно ценными свойствами обладает высокомолекулярный полимер формальдегида - полиформальдегид (стр. 327).
Значительное количество формальдегида идет на приготовление изопрена (2-метилбутадиена-1,3)-исходного вещества для получения синтетического каучука.
Процесс получения изопрена из формальдегида и изобутилена протекает в две стадии по схеме:

Вторая стадия процесса протекает при 200-220 °С в присутствии производных фосфорной кислоты в качестве катализатора.
Формальдегид служит исходным веществом для производства красителей, фармацевтических препаратов, синтетического каучука, взрывчатых веществ и многих других органических соединений. Формальдегид ядовит и даже в небольших концентрациях действует раздражающе на слизистые оболочки.
Формалин (водный раствор формальдегида) довольно широко применяется в качестве антисептика (обеззараживающего средства). Интересно, что консервирующее действие дыма при копчении продуктов питания (рыба, мясо) объясняют сильным антисептическим действием формальдегида, образующегося в результате неполного сгоранйя топлива и содержащегося в дыме в небольшом количестве.
Промышленным методом получения формальдегида является каталитическое окисление метанола. Метанол окисляют в газовой фазе кислородом воздуха при 500-600 °С:

В качестве катализаторов, применяются металлические медь или серебро, осажденные на инертном пористом носителе, или в виде металлической сетки. (В последнее время стали применять, более эффективный железоокисномолибденовый
катализатор.) Для понижения температуры процесса, что благоприятствует реакции окисления и увеличению выхода формальдегида, к метанолу добавляют 10-12% воды.
На рис. 15 приведена принципиальная схема получения формальдегида путем окисления Метанола.
В испаритель 2 поступают метанол из мерника 1 и очищенный воздух через воздуходувку 4. В испарителе жидкий метанол испаряется и смешивается с воздухом, в результате чего образуется паровоздушная смесь с содержанием метанола на смеси. Нагретая до 100 °С паровоздушная смесь поступает в контактный аппарат 6, в котором и происходит окисление метанола при

Рис. 15. Схема производства формальдегида окислением метанола: 1 - мерник; 2 - испаритель; 3 - фильтр; 4 - воздуходувка; 5 - подогреватель; 6 - контактный аппарат; 7 - холодильник; 8, 10 - абсорберы; 9 - промежуточный холодильник.
Продукты реакции направляются в холодильник 7, где они охлаждаются до 100-130 °С. Затем они поступают в абсорберы 8 и 10, в которых поглощается образовавшийся формальдегид.. Абсорбер 8 орошается разбавленным раствором формальдегида, поступающим из абсорбера 10, орошаемого водой. Таким образом, полученный формальдегид выходит из абсорбера в виде водного раствора, содержащего 37,6% формальдегида и около 10% метанола. Выход формальдегида около 80%. Отоходящие из абсорбера 10 газы содержат азот (около 70%), водород (около 20%) и небольшие количества метана, кислорода, окиси и двуокиси углерода.
В последнее время получил промышленное применение способ синтеза формальдегида путем неполногб окисления концентрированного метана кислородом воздуха:

Катализатором служат окислы азота. (Окисление проводят., при температуре около 600 °С.
Уксусный альдегид (ацетальдегид) СН3-СНО. Бесцветная жидкость с резким запахом, хорошо растворимая в воде; темп. кип. +21°С. Под действием кислот он легко полимеризуется в циклические полимеры - паральдегид (жидкость), и метальдегид (твердое вещество).
Уксусный альдегид является важнейшим исходным соединением для получения уксусной кислоты, синтетических полимеров, лекарственных соединений и многих других веществ.
В промышленности имеют наибольшее распространение следующие методы получения ацетальдегида:
1. Прямая гидратация ацетилена водяным паром в присутствии жидких ртутных катализаторов (по реакции Кучерова).
3. Прямое окисление этилена кислородом воздуха в присутствии жидких палладиевых катализаторов.
Гидратация ацетилена в присутствии ртутных катализаторов проводит путем пропускания ацетилена, смешанного с водяным паром при 90-100°С, в гидрататор, заполненный катализатором, так называемой «контактной» кислотой (раствор сернокислой ртути в серной кислоте). В гидрататор также поступает непрерывно или периодически) металлическая ртуть, образующая с серной кислотой сернокислую ртуть. Смесь ацетилена с водяным паром барботирует через кислотный слой; при этом происходит гидратация ацетилена и образование ацетальдегида. Парогазовую смесь, выходящую из гидрататора, конденсируют и выделенный ацетальдегид отделяют от примесей. Выход ацетальдегида (считая на ацетилен) достигает 95%.
При гидратации ацетилена в присутствии нертутных катализаторов ацетилен разбавляют азотом, смешивают с водяным паром и полученную парогазовую смесь пропускают при высокой температуре над нертутным катализатором, например окислами цинка, кобальта, хрома или других металлов. Продолжительность контакта парогазовой смеси с катализатором составляет доли секунды, вследствие этого отсутствуют побочные реакцииг что приводит к увеличению выхода ацетальдегида и получению более чистопб продукта.
Весьма перспективным промышленным методом получения ацетальдегида является прямое окисление этилена кислородом воздуха в присутствии жидких палладиевых катализаторов:

Реакция протекает по значительно более сложной схеме, чем это изображено выше, причем образуется целый ряд побочных продуктов. Процесс проводят в трубчатых реакторах при температуре около 120 °С и давлении .
Ацетон (диметилкетон) Бесцветная жидкость с характерным запахом, хорошо растворимая в воде, темп. кип. 56,1 °С.
Ацетон является прекрасным растворителем многих органических веществ, и поэтому широко применяется в различных отраслях промышленности (производство искусственного волокна, лекарственных препаратов и др.). Ацетон используютлгакже Для синтеза различных органических соединений.
Из ацетона и ацетилена А. Е. Фаворским был получен изопрен. Реакция протекает в три стадии:

Основным промышленным методом получения ацетона является получение его из изопропилбензола одновременно с фенолом (стр. 234).
Некоторое количество ацетона получается окислительным дегидрированием или дегидрированием изопропилового спирта.
Окислительное дегидрирование изопропилового спирта может быть проведено над серебряным катализатором при 450-500 °C:

В качестве побочных продуктов образуются двуокись углерода, пропилен и уксусная кислота. Этот процесс может проводиться также в жидкой фазе при атмосферном давлении и температуре около 150 °С:

Образующаяся перекись водорода используется для различных синтезов, например для получения глицерина из акролеина (стр. 96).
Дегидрирование изопропилового спирта проводят в паровой фазе при 350-400 °С в присутствии медного катализатора:

(для простейшего альдегида R=H)
Классификация альдегидов
По строению углеводородного радикала:
Предельные; например:

Непредельные; например:

Ароматические; например:

Алициклические; например:

Общая формула предельных альдегидов

Гомологический ряд, изомерия, номенклатура

Альдегиды изомерны другому классу соединений - кетонам

например:

Альдегиды и кетоны содержат карбонильную группу ˃C=O, поэтому называются карбонильными соединениями.
Электронное строение молекул альдегидов
Атом углерода альдегидной группы находится в состоянии sp 2 -гибридизации, поэтому все σ-связи в этой группе располагаются в одной плоскости. Облака р-электронов, образующих π-связь, перпендикулярны этой плоскости и легко смещаются к более электроотрицательному атому кислорода. Поэтому двойная связь C=O (в отличие от двойной связи C=C в алкенах) сильно поляризована.
Физические свойства

Химические свойства
Альдегиды - реакционноспособные соединения, вступающие в многочисленные реакции. Наиболее характерны для альдегидов:
а) реакции присоединения по карбонильной группе; реагенты типа НХ присоединяются следующим образом:

б) реакции окисления связи C-H альдегидной группы, в результате которых образуются карбоновые кислоты:
I. Реакции присоединения
1. Гидрирование (образуются первичные спирты

2. Присоединение спиртов (образуются полуацетали и ацетали)

В избытке спирта в присутствии HCl полуацетали превращаются в ацетали:

II. Реакции окисления
1. Реакция «серебряного зеркала»

Упрощённо:

Эта реакция является качественной реакцией на альдегидную группу (на стенках реакционного сосуда образуется зеркальный налет металлического серебра).
2. Реакция с гидроксидом меди (II)

Эта реакция также является качественной реакцией на альдегидную групп у (выпадает красный осадок Сu 2 O).
Формальдегид окисляется различными O-содержащими окислителями сначала до муравьиной кислоты и далее - до Н 2 СO 3 (СO 2 + Н 2 O):

III. Реакции ди-, три- и полимеризации
1. Альдольная конденсация

2. Тримеризация ацетальдегида

3. Полимеризация формальдегида
При длительном хранении формалина (40%-ный водный раствор формальдегида) в нем происходит полимеризация с образованием белого осадка параформа:

IV. Реакция поликонденсации формальдегида с фенолом

Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.

У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.
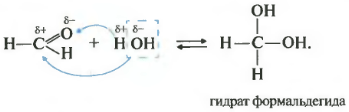
Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты , наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.

Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.
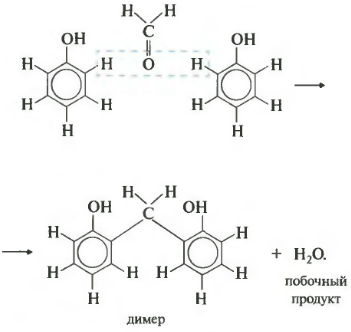
В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.

Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO 2 , проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.








 Внедрение и использование УМК «Изучаем русский язык» в двуязычной образовательной среде
Внедрение и использование УМК «Изучаем русский язык» в двуязычной образовательной среде Система образования в индии как фундамент знаний и жизни
Система образования в индии как фундамент знаний и жизни Роман Вишневский – трейдер и владелец брокерской компании
Роман Вишневский – трейдер и владелец брокерской компании Николай Кольцов – биолог из будущего
Николай Кольцов – биолог из будущего